添付文書 【ラパリムスゲル0.2%】17. 臨床成績
- 質問
-
【ラパリムスゲル0.2%】
17. 臨床成績
- 回答
-
17.1 有効性及び安全性に関する試験
17.1.1 国内第Ⅲ相試験
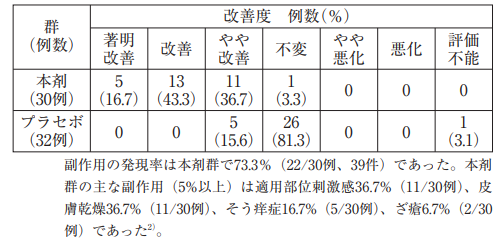
結節性硬化症患者62例(成人35例、小児27例)を対象としたプラセボ対照二重盲検試験において、本剤又はプラセボを1日2回、12週間顔面又は頭部の皮膚病変に塗布した。投与量は病変部50cm 2(両頬の面積に相当)あたり0.125gを目安とし、年齢に応じて1日あたり、5歳以下:0.4g、6~11歳:0.6g、12歳以上:0.8gを上限とした。また、各年齢区分の標準的な体格(体表面積)から大きく逸脱する場合は、体表面積に応じて、体表面積0.8m 2未満:0.4g、0.8m 2以上1.3m2未満:0.6g、1.3m 2以上:0.8gを最大塗布量とした。主要評価項目である12週後の血管線維腫の改善度(中央写真判定)の分布は表のとおりであり、プラセボ群と比較して本剤群で有意な改善が認められた(p<0.001:有意水準両側5%、Wilcoxon順位和検定)。
17.1.2 国内長期投与試験
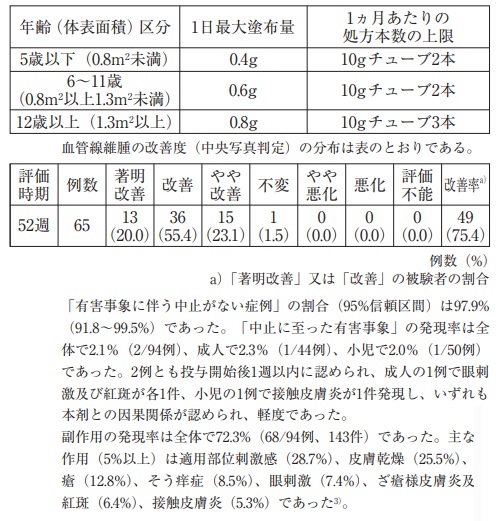
結節性硬化症患者94例(成人44例、小児50例)を対象とした、長期投与における安全性及び有効性を検討する非盲検、非対照試験において、本剤を1日2回顔面又は頭部の皮膚病変に塗布し、52週までの有効性を評価した。投与量は病変部50cm 2(両頬の面積に相当)あたり0.125gを目安とし、下表に示す年齢区分に応じた1日あたりの最大塗布量を超えない範囲で塗布した。ただし、各年齢区分の標準的な体格(体表面積)から大きく逸脱する被験者については、体表面積区分に応じて塗布量及び処方本数の上限値を規定した。
【文献】
2)Wataya-Kaneda M, et al.:JAMA Dermatol 2018;154(7):781-8
3)社内資料:国内長期投与試験(2018年3月23日承認、申請資料概要5.3.5.2)
参考になりましたか?
