添付文書 【ホストイン静注750mg】16. 薬物動態
- 質問
-
【ホストイン静注750mg】
16. 薬物動態
- 回答
-
16.1 血中濃度
健康成人に本剤750mgを25mg/分又は75mg/分の速度で静脈内投与したときの血漿中の未変化体濃度(図1)、総フェニトイン濃度(図2)及び非結合型フェニトイン濃度(図3)の推移(平均±標準偏差)、及びそれぞれの薬物動態パラメータを表1に示す。
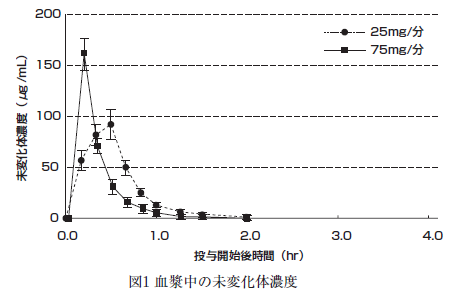
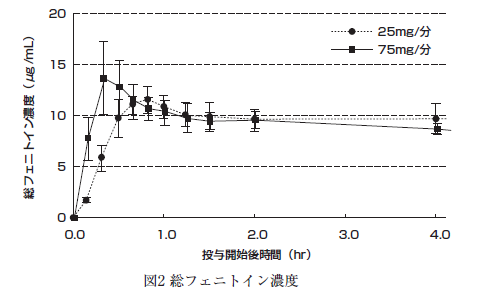
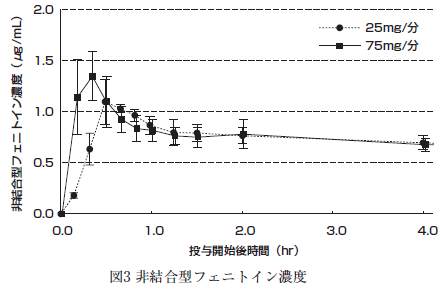
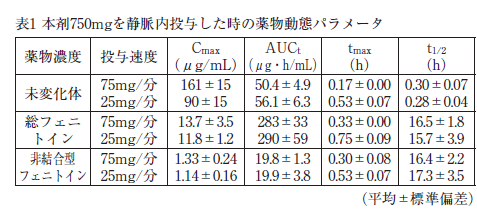
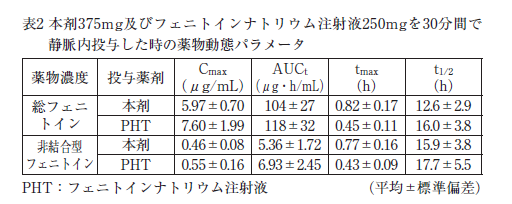
健康成人に本剤375mg(10名、平均体重64.5kg)及びフェニトインナトリウム注射液250mg(10名、平均体重63.9kg)を、それぞれ30分かけて静脈内投与したときの薬物動態パラメータを表2に示す 5)。
16.3 分布
日本人患者における血漿中フェニトインの蛋白結合率は85.7~88.1%であり、年齢により大きな差異は認められなかった 6)。
16.4 代謝
本剤投与後に、アルカリホスファターゼによりフェニトインの他、ホルムアルデヒド及びリン酸塩が生成し、ホルムアルデヒドはすみやかにギ酸塩に変化する。フェニトインは、主としてCYP2C9により代謝を受け 2)、また一部CYP2C19によっても代謝を受ける 3)。[10. 参照]
16.5 排泄
本剤投与後、体内でホスフェニトインは2時間以内にフェニトインにほぼ完全に変換され、フェニトインは、肝で主として5-(4’-hydroxyphenyl)-5-phenylhydantoin(p -HPPH)及びそのグルクロン酸抱合体に代謝され、尿中に排泄される。尿中には未変化体のホスフェニトインは検出されず、フェニトインは投与量の2%未満であった 7),8)。
16.6 特定の背景を有する患者
16.6.1 肝機能障害及び腎機能障害患者の薬物動態(外国人)
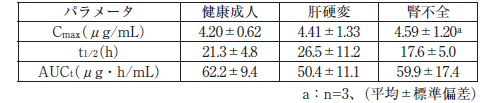
健康成人、肝硬変患者及び腎不全患者各4例に、本剤375mg(投与速度12.5mg/分)を投与したときの血漿中総フェニトインの薬物動態パラメータは次のとおりであった 9)。[9.2、9.3 参照]
16.7 薬物相互作用
16.7.1 ジアゼパムとの併用(外国人)
健康成人9名(平均体重77.2kg)を対象に本剤(1,125mg)とジアゼパム(10mg)を静脈内に併用投与した時、血漿中フェニトインのCmax及びAUCtは、ジアゼパム非併用時と比較してそれぞれ7.8%及び1.8%減少した。一方、血漿中ジアゼパムのCmaxは、本剤非併用時と比較して10%減少し、AUCtは16%増加した 10)~12)。
【文献】
2)Veronese ME, et al. : Biochem Biophys Res Commun. 1991; 175: 1112-83)Bajpai M. : Drug Metab Dispos. 1996; 24: 1401-35)社内資料:第Ⅰ相試験(臨床薬物動態試験)(2011年7月1日承認、申請資料概要2.7.2.2.2)
6)社内資料:第Ⅲ相試験(安全性、有効性及び薬物動態の検討)(2011年7月1日承認、申請資料概要2.7.2.3.5、2.7.6.2.1)
7)社内資料:漸増投与臨床薬物動態試験(RR744-00086)(2011年7月1日承認、申請資料概要2.7.2.2.2、2.7.2.3.7)
8)社内資料:フェニトイン対照臨床薬物動態試験(RR744-00152)(2011年7月1日承認、申請資料概要2.7.2.2.2、2.7.2.3.7)
9)Aweeka F, et al. : Am Soc Clin Pharm Ther. 1989: 152(PIIK-2)
10)Hussey EK, et al. : Pharm Res. 1988: S-214(PP1463)
11)Hussey EK, et al. : Pharmacotherapy. 1989 ACCP ABSTRACTS:195-6(151E, 152E)
12)Hussey EK, et al. : Pharm Res. 1990; 7: 1172-6
参照箇所については、下の「関連する質問」をクリックして下さい。
