添付文書 【アセノベル徐放錠500mg】17. 臨床成績
- 質問
-
【アセノベル徐放錠500mg】
17. 臨床成績
- 回答
-
17.1 有効性及び安全性に関する試験
17.1.1 国内第Ⅲ相試験①(シアル酸-3試験)
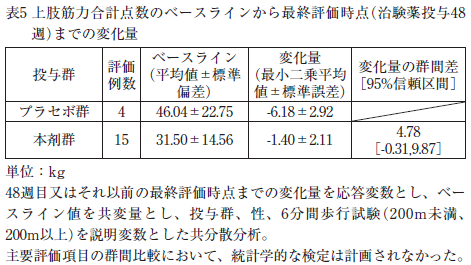
GNE遺伝子変異を有する縁取り空胞を伴う遠位型ミオパチー患者20例(うち6分間歩行試験の歩行距離200m以上が18例)を対象としたプラセボ対照二重盲検比較試験が実施された。その結果、主要評価項目である上肢筋力合計点数のベースラインから最終評価時点(治験薬投与48週)までの変化量は表5のとおりであった。
副作用は25.0%(4/16例)に認められ、口角口唇炎、頭痛、便秘、発疹、四肢痛が各1例であった 4)。
17.1.2 国内第Ⅲ相試験②(NPC-09-1試験)
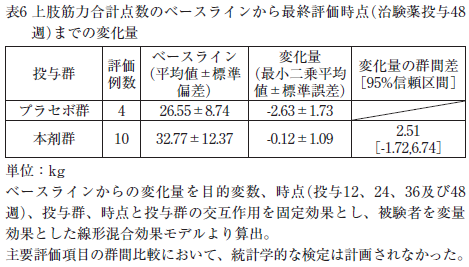
GNEミオパチー機能活動尺度(GNEM-FAS)の上肢部分の点数が24点以上かつ罹病期間が5年以上15年以下のGNE遺伝子変異を有する縁取り空胞を伴う遠位型ミオパチー患者14例を対象としたプラセボ対照二重盲検比較試験が実施された。その結果、主要評価項目である上肢筋力合計点数のベースラインから最終評価時点(治験薬投与48週)までの変化量は表6のとおりであった。
副作用は認められなかった 9)。
17.2 製造販売後調査等
記載なし
17.3 その他
記載なし
【文献】
4)社内資料:国内第Ⅱ/Ⅲ相試験(2024年3月26日承認、申請資料概要2.7.6.1)
9)社内資料:国内有効性確認試験(2024年3月26日承認、申請資料概要2.7.6.3)
参考になりましたか?
