添付文書 【メラトベル顆粒小児用0.2%,錠小児用1mg・2mg】16. 薬物動態
- 質問
-
【メラトベル顆粒小児用0.2%,錠小児用1mg・2mg】
16. 薬物動態
- 回答
-
16.1 血中濃度
16.1.1 単回投与(健康成人)
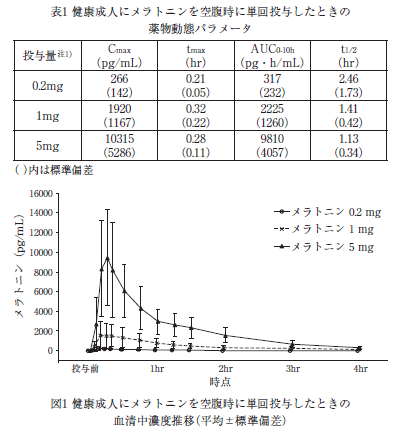
メラトニン0.2mg 注1)を男性6例、1mgを男性6例、5mg 注1)を男性及び女性各6例に空腹時に単回経口投与したとき、血清中メラトニン濃度の薬物動態パラメータ及び濃度推移は表1及び図1のとおりである 9)。
16.1.2 単回投与(幼児及び小児)
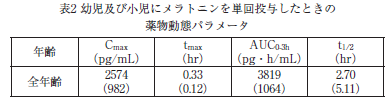
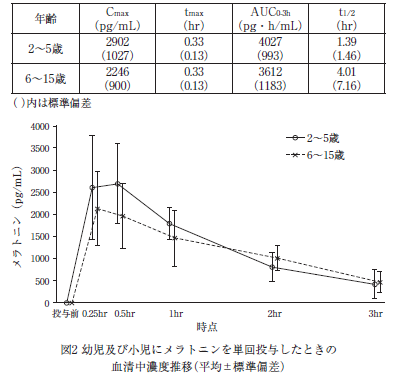
メラトニン0.04mg/kg 注1)を2~5歳の6例(投与量0.5~0.9mg/body 注1))及び6~15歳の6例(投与量0.8~3.3mg/body 注1))に単回経口投与したとき、血清中メラトニン濃度の薬物動態パラメータ及び濃度推移は表2及び図2のとおりである 10)。
16.1.3 生物学的同等性試験
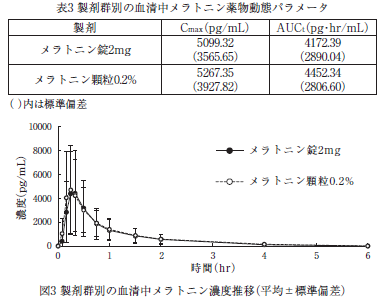
健康成人男性48例にメラトニン錠2mg 1錠及びメラトニン顆粒0.2% 1g(いずれもメラトニンとして2mg)をクロスオーバー法により絶食時に単回経口投与したときの血清中メラトニン濃度の薬物動態パラメータ(C max及びAUC t)及び濃度推移は表3及び図3のとおりである。C max及びAUC tの対数の平均値の差について90%信頼区間はlog(0.80)~log(1.25)の範囲内であったことから、両製剤は生物学的に同等であることが確認された 11)。
メラトニン錠1mgは「含量が異なる経口固形製剤の生物学的同等性試験ガイドライン」に基づき、メラトニン錠2mgを標準製剤としたとき、溶出挙動は同等と判定され、生物学的に同等とみなされた。
16.2 吸収
16.2.1 食事の影響
健康成人6例を対象とした国内臨床試験(単回投与試験)において、メラトニン1mgを空腹時又は食後に単回経口投与したとき、空腹時に比べ食後投与時のC maxは15.4%低下し、AUC 0-10hは18.7%増加し、t 1/2は11.9%増加した 9)。[7.3参照]
16.2.2 バイオアベイラビリティ
海外で行われた臨床研究の結果より、メラトニン経口投与時のバイオアベイラビリティは2.5~33%であった 12)~15)。
16.3 分布
メラトニンの in vitroにおけるヒト血清蛋白結合率は、メラトニン0.0928~197ng/mLの濃度範囲で約53%であった 16)。
メラトニンの静脈内投与から求めた分布容積は0.98~1.2L/kgであり 12),13)、血漿容積と比べて大きかった。
16.4 代謝
本剤は主としてCYP1A2により代謝される。その他、CYP1A1、CYP1B1及びCYP2C19が代謝に関与している 17)。[10参照]
16.5 排泄
主要代謝物である6-SMTは、腎臓から尿中排泄される。メラトニン0.2~5mg 注1)を健康成人に投与したとき、投与後24時間までの尿中排泄量の約90%が投与後10時間までに排泄された 9)。
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
腎機能別に分けた4群(eGFR 注2):>80mL/分、60-80mL/分、30-60mL/分、<30mL/分)で内因性メラトニン濃度を比較した結果、eGFRの悪化に伴い、内因性メラトニン濃度の日内変動幅が小さくなるとの報告がある 18)。[9.2参照]
16.6.2 肝機能障害患者
肝硬変患者の内因性メラトニン濃度は肝硬変の進行に伴い上昇し、健康成人で10.6±1.7pg/mL、肝硬変患者(Child-Pugh分類 Grade A:31.2±9.8pg/mL、Grade B:49.8±12.2pg/mL、Grade C:94.8±22.6pg/mL)と最大で約10倍の差があったとの報告がある 19)。
また、肝硬変患者にメラトニンを静脈内注射したとき、健康成人と比較して血清中メラトニンのt 1/2は2.1~2.2倍に延長したとの報告がある 20)。[9.3参照]
16.7 薬物相互作用
16.7.1 フルボキサミンマレイン酸塩
健康成人にメラトニン5mg 注1)の経口投与の3時間前にフルボキサミン50mgを投与したとき、メラトニンのC maxが1074±507%、AUCが1635±1023%に増加したとの報告がある。t 1/2は単独投与時で9.4±2.5時間、併用投与時で13.4±10.7時間であった 4)。[2.2、10.1参照]
16.7.2 カフェイン
健康成人にメラトニン6mg 注1)の経口投与の1時間前、1時間後及び3時間後にカフェイン200mgを経口投与したとき、メラトニンのC maxが137%、AUCが120%増加したとの報告がある 5)。[10.2参照]
16.7.3 喫煙
喫煙者を7日間禁煙させメラトニン25mg 注1)を経口投与したところ、禁煙前と比較し血清中濃度が約2.9倍と有意に上昇し、AUCも増加したとの報告がある 6)。[10.2参照]
注1)本剤の承認された用法及び用量は、1日通常1mg、最大4mgの単回経口投与である。
注2)Cockcroft-Gault式による
16.8 その他
記載なし
【文献】
4)Härtter S, et al. : Clin Pharmacol Ther. 2000; 67(1): 1-6
5)Härtter S, et al. : Br J Clin Pharmacol. 2003; 56(6): 679-82
6)Ursing C, et al. : Eur J Clin Pharmacol. 2005; 61(3): 197-201
9)社内資料:第Ⅰ相試験(2020年3月25日承認、申請資料概要5.3.3.1-1)
10)社内資料:臨床薬理試験(小児PK)(2020年3月25日承認、申請資料概要5.3.3.1-2)
11)社内資料:錠剤と顆粒剤の生物学的同等性試験(2025年3月14日承認、申請資料概要2.7.6.1)12)Fourtillan JB, et al. : Biopharm Drug Dispos. 2000; 21(1): 15-22
13)Andersen LP, et al. : BMC Pharmacol Toxicol. 2016; 17: 8
14)DeMuro RL et al. : J Clin Pharmacol. 2000; 40(7): 781-4
15)Di WL, et al. : N Engl J Med. 1997; 336(14): 1028-9
16)Morin D, et al. : Pharmacology. 1997; 54(5): 271-5
17)Ma X, et al. : Drug Metab Dispos. 2005; 33(4): 489-94
18)Koch BC, et al. : Nephrol Dial Transplant. 2010; 25(2): 513-9
19)Chojnacki C, et al. : Pol Arch Med Wewn. 2012; 122(9): 392-6
20)Iguchi H, et al. : J Clin Endocrinol Metab. 1982; 54(5): 1025-7
参照箇所については、下の「関連する質問」をクリックして下さい。
関連する質問
参考になりましたか?
