添付文書 【ノベルジン錠25mg・50mg,顆粒5%】17. 臨床成績
- 質問
-
【ノベルジン錠25mg・50mg,顆粒5%】
17. 臨床成績
- 回答
-
17.1 有効性及び安全性に関する試験
〈ウィルソン病(肝レンズ核変性症)〉
17.1.1 国内第Ⅲ相試験
ウィルソン病患者37例(16歳以上20例、6歳以上~16歳未満15例、1歳以上~6歳未満2例)を対象にノベルジンカプセル(16歳以上の患者は50mg×3回/日、6歳以上~16歳未満の患者は25mg×3回/日、1歳以上~6歳未満の患者は25mg×2回/日)を48週間投与した臨床試験の結果は以下のとおりであった。
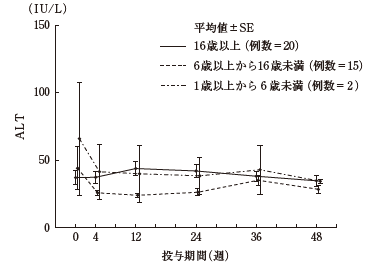
主要評価項目であるALTの平均値の推移は以下のとおりで、各年齢区分で安定した推移を示した。
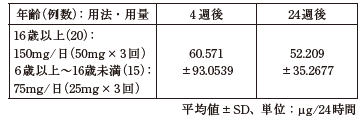
35例のウィルソン病患者(6歳以上)で検討された24時間尿中銅排泄量は以下のとおりで、4週後、24週後とも管理閾値(125μg/24時間)以下に維持された。
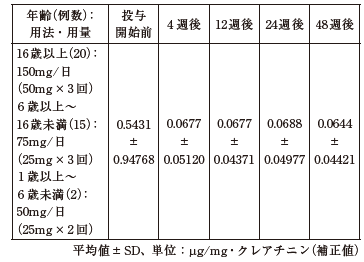
37例のウィルソン病患者で検討されたスポット尿中銅排泄量は以下のとおりで、投与4週後以降有意に減少した。
副作用発現頻度は91.9%(34/37例)であった。主な副作用(10%以上)は、リパーゼ増加75.7%(28/37例)、アミラーゼ増加54.1%(20/37例)、血清鉄低下45.9%(17/37例)、胃不快感16.2%(6/37例)、総コレステロール減少10.8%(4/37例)、尿潜血陽性10.8%(4/37例)であった 8)。
〈低亜鉛血症〉
17.1.2 国内第Ⅲ相試験(比較試験)
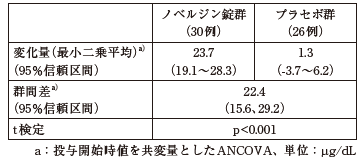
低亜鉛血症患者56例(24歳以上93歳以下)を対象にノベルジン錠(25mg×2回/日)又はプラセボを8週間投与したプラセボ対照二重盲検試験において、血清亜鉛濃度の投与開始時から投与8週後/中止時の変化量では、両群間に有意差が認められた(p<0.001)。
副作用の発現頻度は12.9%(4/31例)であり、悪心6.5%(2/31例)、そう痒症6.5%(2/31例)、血中鉄増加3.2%(1/31例)、咳嗽3.2%(1/31例)、湿性咳嗽3.2%(1/31例)であった 10)。
17.1.3 国内第Ⅲ相試験(用量増減法確認試験)
低亜鉛血症患者43例(4歳以上82歳以下)を対象に、ノベルジン錠(開始用量:体重30kg以上の患者は25mg×2回/日又は50mg×2回/日、30kg未満の患者は25mg×1回/日)を最大24週間投与し、目標血清亜鉛濃度(80以上200μg/dL未満)到達までの用量調節方法及び到達後の維持効果を検討した臨床試験において、目標血清亜鉛濃度を8週間維持できた症例の割合は86.0%(37/43例)であった。
副作用の発現頻度は44.2%(19/43例)であり、主な副作用(5%以上)は、リパーゼ増加14.0%(6/43例)、嘔吐7.0%(3/43例)、血清銅減少7.0%(3/43例)であった 11)。
17.1.4 国内第Ⅲ相試験(小児)
小児低亜鉛血症患者12例(10ヵ月以上17歳以下)を対象に、ノベルジン顆粒(開始用量:1.0mg/kg/日又は1.5mg/kg/日)を最大28週間投与した臨床試験において、目標血清亜鉛濃度(80μg/dL以上)を同一投与量で8週間維持できた症例の割合は91.7%(11/12例)であった。
副作用の発現頻度は33.3%(4/12例)であり、便秘16.7%(2/12例)、ALT増加16.7%(2/12例)、嘔吐8.3%(1/12例)、AST増加8.3%(1/12例)、γ-グルタミルトランスフェラーゼ増加8.3%(1/12例)、発熱8.3%(1/12例)であった 12)。
17.2 製造販売後調査等
〈ウィルソン病(肝レンズ核変性症)〉
17.2.1 特定使用成績調査
安全性解析対象症例707例の副作用の発現頻度は49.1%(347/707例)で、5例(0.7%)以上発現した主な副作用は、悪心84例(11.9%)、リパーゼ増加62例(8.8%)、アミラーゼ増加61例(8.6%)、ALT増加43例(6.1%)、AST増加33例(4.7%)、腹部不快感31例(4.4%)等であった。観察期間中に妊娠が1回以上「あり」と報告された症例は29例収集され、副作用は5例6件(流産、稽留流産、羊水過少、子宮頚管短縮、人工流産、帝王切開)であった。出生児32例及び人工流産した胎児1例には、5例13件の異常(多発性先天異常、心音異常、尿道下裂等)が認められた。
(再審査終了時)
17.2.2 製造販売後臨床試験
国内第Ⅲ相長期投与試験の被験者を対象に、本剤承認後から投与終了までの安全性の検討を目的とした製造販売後臨床試験を実施した。副作用の発現頻度は14.7%(5/34例)であり、認められた副作用は、血中鉄減少5.9%(2/34例)、ALT増加、AST増加、血中クロール増加及びリパーゼ増加が各2.9%(1/34例)であった。
17.3 その他
記載なし
【文献】
8)社内資料:ウィルソン病に対する国内第Ⅲ相試験(2008年1月25日承認、申請資料概要2.7.6(10))
10)社内資料:低亜鉛血症に対する国内第Ⅲ相二重盲検比較試験(2017年3月24日承認、申請資料概要2.7.6.1)
11)社内資料:低亜鉛血症に対する国内第Ⅲ相用量増減法確認試験(2017年3月24日承認、申請資料概要2.7.6.2)
12)社内資料:小児低亜鉛血症に対する国内第Ⅲ相試験(2021年1月22日承認、申請資料概要2.7.6.2)
参考になりましたか?
