添付文書 【ジェミーナ配合錠】17. 臨床成績
- 質問
-
【ジェミーナ配合錠】
17. 臨床成績
- 回答
-
17.1 有効性及び安全性に関する試験
〈月経困難症〉
17.1.1 国内第Ⅲ相試験
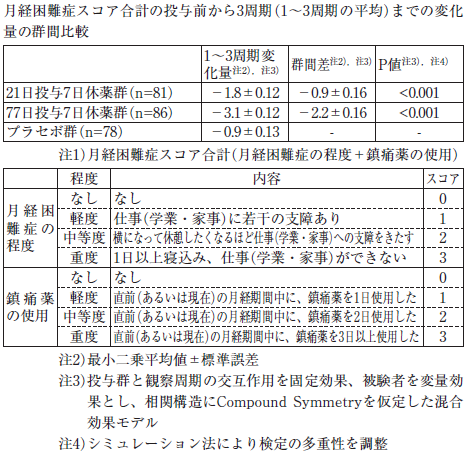
月経困難症患者(21日投与7日休薬群:16~50歳、平均32.1歳、77日投与7日休薬群:17~48歳、平均31.6歳、プラセボ群:18~47歳、平均33.1歳)を対象としたプラセボ対照比較試験において、月経困難症スコア合計 注1)の投与前から3周期(1~3周期の平均)までの変化量は、21日投与7日休薬群及び77日投与7日休薬群のいずれもプラセボ群と比較して有意差が認められた。また、月経困難症に対する効果は投与52週まで持続することが確認された 6)。
副作用(臨床検査値異常を含む)の発現頻度は、88.8%(214/241例)であった。
21日投与7日休薬群(プラセボからの切り替え症例を含む)における副作用の発現頻度は83.2%(129/155例)であった。主な副作用(10%以上)は、不正子宮出血67.7%(105例)、希発月経27.1%(42例)、月経過多18.7%(29例)、下腹部痛14.2%(22例)であった。77日投与7日休薬群における副作用の発現頻度は98.8%(85/86例)であった。主な副作用(10%以上)は、不正子宮出血95.3%(82例)、希発月経86.0%(74例)、月経過多32.6%(28例)、無月経31.4%(27例)、下腹部痛31.4%(27例)、頭痛12.8%(11例)、悪心11.6%(10例)であった 6)。
17.2 製造販売後調査等
記載なし
17.3 その他
記載なし
【文献】
6)社内資料:第Ⅲ相長期投与試験-無作為化プラセボ対照二重盲検比較試験(2018年7月2日承認、申請資料概要2.7.6.2)
参考になりましたか?
